В современных условиях для диагностики патогенов все более широко и успешно используются молекулярно-генетические методы. Прежде всего, это метод полимеразно-цепной реакции (ПЦР) и его модификации: прямая, с обратной транскрипцией ОТ-ПЦР (RT-PCR), вложенная (NESTED PCR), изометрическая (LAMP PCR), FLASH- ПЦР (FLASH-PCR), ПЦР в реальном времени (Realtime - RQ-PCR), матричный микрочиповый ПЦР (MICROCHIP PCR), мультипраймерная ПЦР (MULTIPLEX PCR, MULTIPRIMER PCR), цифровая ПЦР (DIGITAL PCR, dPCR), секвенирования следующего поколения (NGS). Достоинствами этих тестов являются их специфичность и высокая чувствительность, позволяющие поставить точный диагноз при минимальных концентрациях возбудителей, когда применение других общепринятых методов не эффективно [97].
Метод полимеразной цепной реакции - ПЦР
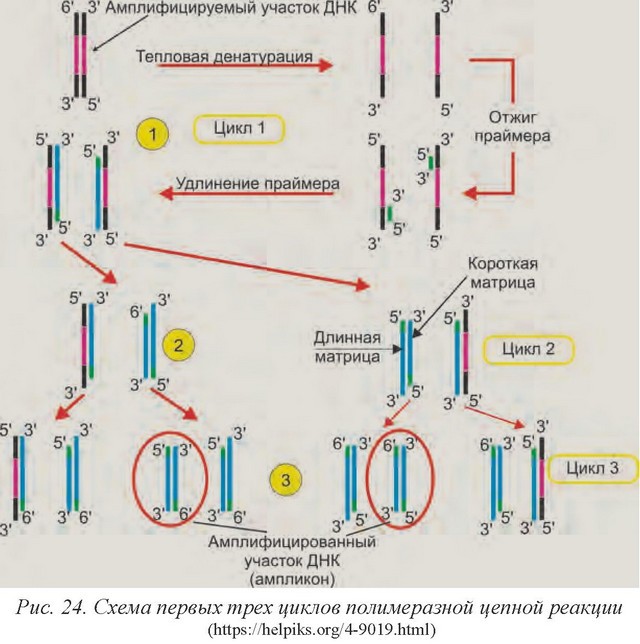
Метод ПЦР (рис. 24) произвел настоящую революцию в биотехнологии, с его помощью идентификацию патогенных микроорганизмов можно провести всего за один день, ее легко автоматизировать, реакция сравнительно недорога и чрезвычайно специфична.
ПЦР основана на многократном копировании (амплификации) определённого участка ДНК при помощи особой ДНК полимеразы, способной осуществлять синтез при повышенной температуре in vitro. При этом происходит копирование только заранее заданного, интересующего исследователя участка, и только в том случае, если он присутствует в исследуемом образце. Достигается это путем использования специфичных праймеров - коротких синтетических нуклеотидов (18-30 оснований), один из которых комплементарен началу интересующего участка на плюс цепи ДНК, а другой - концу этого участка на минус цепи ДНК. В процессе реакции после расплетания матричной ДНК (при повышении температуры) и последующего отжига (при понижении температуры) образуются комплексы между нею и праймерами, которые теперь служат затравкой для ДНК-полимеразы, - начинается достраивание комплементарной цепочки ДНК. Каждый вновь синтезированный фрагмент ДНК может служить матрицей для синтеза новых фрагментов. При многократном повторении циклов повышения и понижения температуры реакционной среды происходит наработка требуемого продукта до количеств, которые легко обнаружить после разделения их электрофорезом в полиакриламидном геле и окрашивания интеркалирующими красителями (например, бромистым этидием).
Для проведения ПЦР требуются следующие компоненты:
• ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать;
• два праймера, комплементарные концам требуемого фрагмента;
• термостабильная ДНК-полимераза - фермент, который катализирует реакцию полимеризации ДНК;
• дезоксинуклеотидтрифосфаты (dATP, dGTP, dCTP, dTTP), которые необходимы для синтеза комплементарной цепи ДНК; ионы Mg2+, необходимые для работы полимеразы;
• буферный раствор, обеспечивающий условия реакции - рН, ионную силу раствора;
• праймеры - искусственно синтезированные олигонуклеотиды размером от 15 до 30 пар нуклеотидов, каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы в начале и в конце амплифицируемого участка. Правильно подобранные праймеры обеспечивают специфичность и чувствительность тест-системы.
Ход реакции. Обычно при проведении ПЦР выполняется 30 и более циклов, на каждом из которых количество синтезированных копий фрагмента ДНК удваивается. Каждый цикл состоит из трех стадий:
денатурация - двухцепочечную ДНК-матрицу нагревают до 9496 °C в течение 0,5-2 мин, при этом разрушаются водородные связи между двумя цепями ДНК, и они расходятся;
отжиг - температуру понижают на несколько десятков градусов (конкретное значение температуры отжига зависит от нуклеотидной последовательности праймеров). Праймеры связываются с одноцепочечной матрицей. Продолжительность стадии составляет 0,5-2 мин. Неправильный выбор температуры отжига приводит к плохому связыванию праймеров с матрицей (завышенная температура) либо к связыванию в неверном месте и появлению неспецифических продуктов (заниженная температура);
элонгация (синтез) - на третьем этапе температуру в реакционной смеси доводят до оптимума работы Taq-полимеразы (72 °С), которая начинает достраивать вторую цепь ДНК с 3’-конца праймера и движется вдоль матрицы. Продолжительность стадии составляет 3 мин.
Количество циклов в ПЦР зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. По окончании всех циклов проводят дополнительную - финальную - стадию элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7-10 мин.
Кроме «классической» ПЦР применяют и ее многочисленные разновидности. Например, в случае низкого содержания патогена в растительном материале, что часто характерно для фитоплазменной инфекции, используют «вложенную», или «гнездовую» ПЦР (от англ. Nested PCR), которая позволяет увеличить чувствительность метода диагностики. Суть метода заключается в последовательном проведении двух амплификаций с двумя разными парами праймеров. ПЦР-продукт амплификации с первой парой праймеров используется в качестве матрицы для амплификации со второй парой праймеров, комплементарных последовательностям, расположенным внутри этого ПЦР-продукта, и, соответственно, более короткого.
Во ВНИИФ при прямом ПЦР для идентификации фитоплазм, поражающих овощные культуры применяют праймеры Р1/Р7 (P1 (forward): 5'-AAG AGT TTG ATC CTG GCT CAG GAT T-3' и P7 (reverse): 5'-CGT CCT TCA TCG GCT CTT-3') или P1/16S-SR. Из листьев растений вырезают и замораживают жилки при температуре — 20 °С, 0,3 г ткани растирают в фарфоровой ступке с 3 мл CTAB-буфера. ДНК экстрагируют в соответствии инструкцией Qiagen DNeasy Plant Mini Kit (Qiagen, Valencia, CA). При прямом ПЦР в амплифи- каторе устанавливают следующий температурно-временной режим: 94 °С - 5 мин, 38 циклов (при температуре 94 °С - 1 мин, 55 °С - 2 мин, 72 °С - 3 мин) и 72 °С - 8 мин. При идентификации фитоплазм кроме прямого ПЦР 16Sr РНК фитоплазм (в случае неоднозначных результатов при прямом ПЦР), используется дополнительно вложенный ПЦР с использованием праймеров R16F2n/R16R2: (R16F2n: 5’-GAA ACG ACT GCT AAG ACT GG-3’; R16R2: 5’-TGA CGG GCG GTG TGT ACA AAC CCC G-3’; R16R2n 5’- TGACGGGCGGTGTACAAAC-3’). Для этого продукты после прямого ПЦР разводят ddH2O в соотношении 1:30, и этот раствор используют как матрицу. Реакционная смесь и условия ПЦР такие же, как и при проведении прямого ПЦР. Качество и количество ПЦР-продуктов после амплификации проверяют методом электрофореза в агарозном геле.
Для визуализации ПЦР-продуктов гель агарозы окрашивают красителями: GelRed, SYBR Safe DNA Gel stain или после электрофореза бромистым этидием. После электрофореза окрашенный гель просматривают в трансиллюминаторе под УФ или, используя любую гель-документирующую систему, позволяющую просматривать гель в УФ и сохранять изображение геля. ПЦР-продукты нужного размера в дальнейшем используют для проведения ПДРФ-анализа. При этом каждый ПЦР-продукт отдельно обрабатывают эндонуклеазами рестрикции AluI, HhaI, HpaII, VseI (TruII), Rsal, Taql. Электрофорез проводят в полиакриламидном геле и после визуализации в УФ полученные снимки сравнивают с опубликованными реальными или виртуальными картами рестрикции [98, 99].
На рис. 25 представлена виртуальная «электрофореграмма» фрагментов 16S рДНК фитоплазмы ‘Ca. phytoplasma solani’, полученная in silico, т.е. с помощью компьютерного моделирования рестрикции ДНК 17 различными эндонуклеазами [100].
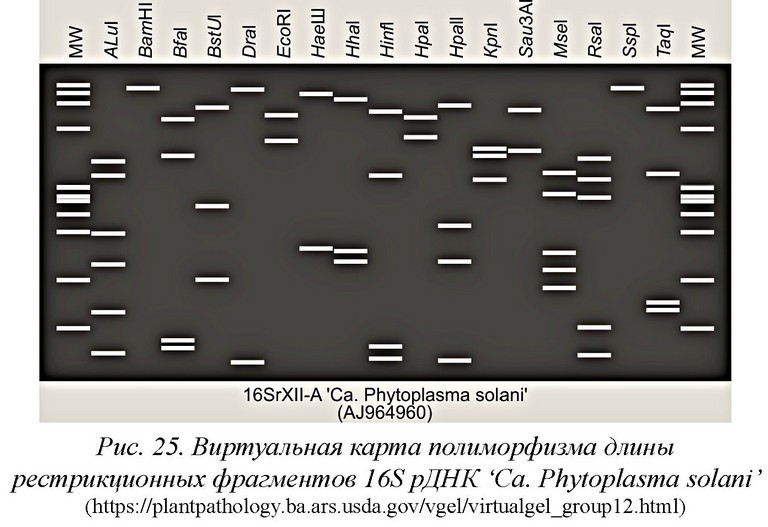
Нуклеотидная последовательность этой 16S рДНК (фитоплазмы столбура картофеля) была получена из базы данных GenBank (регистрационный номер GenBank AJ964960). На основании анализа полиморфизма длины рестрикционных фрагментов (ПДРФ - англ. Restriction fragment length polymorphism) и реальных электрофоре- граммм, полученных в результате ферментативного расщепления 16S рДНК, амплифицированной в ПЦР, эта фитоплазма была первоначально отнесена к группе/подгруппе 16SrXII-А. Классификация, основанная на представленных здесь виртуальных «электро- фореграммах», полностью согласуется с исходной классификацией. Подобные карты составлены для 28 групп и множества известных подгрупп в этих группах.
На 2018 г. установлено разделение фитоплазм на 36 (16Sr) ри- босомальных групп и более 150 подгрупп. Для отдельных видов фитоплазм созданы специфические праймеры, например, для определения фитоплазм столбура Maixner и др. (1995) рекомендуют использовать следующие праймеры: rStol: 5-AGA TGT GAC CTA TTT TGG TGG-3 и fStol: GCC ATC ATT AAG TTG GGG A. Для выявления штаммовых различий в пределах подгрупп анализируют также ри- босомные (rplV и rpsC) и экстрарибосомных гены (secY, map, uvrB, degV и tuf). Продукты ПЦР секвенируют либо напрямую, либо путем их предварительного клонирования в вектор для клонирования ПЦР. Данные последовательности можно проанализировать с помощью инструмента поиска базового локального выравнивания, BLASTN, доступного по адресу Национального центра биотехнологической информации [101].
Если последовательность имеет менее 97,5 % идентичности со своим ближайшим родственником, фитоплазма считается новым ‘Ca. видом фитоплазмы. В этом случае следует секвенировать весь ген 16S рРНК и провести филогенетический анализ. Секвенируют также отдельные области генома, такие как 16S/23S, а также спейсерные области рРНК, ген secY, гены рибосомного белка или ген tuf [102-105]. Для идентификации большинства фитовирусов и вироидов применяется разновидность ПЦР — метод обратной транскрипции ОТ-ПЦР.
ПЦР с обратной транскрипцией, ОТ-ПЦР (Reverse Transcription PCR, RT-PCR)
Как известно, у большинства растительных вирусов геном представлен одноцепочечной РНК, вироид также состоит из одноцепочечной ковалентнозамкнутой РНК, но из-за высокого процента спаренных оснований, обладает упорядоченной структурой. Однако ПЦР может быть использована и для диагностики РНК- содержащих вирусов и вироидов, поскольку еще в 1970 г. был открыт фермент - обратная транскриптаза (она же ревертаза, или РНК-зависимая ДНК-полимераза), который синтезирует ДНК на матрице РНК. Эта кДНК затем используется в качестве матрицы для ПЦР.
Метод ОТ-ПЦР является чувствительной методикой, с помощью которой может быть обнаружено малое количество молекул РНК вироида и РНК-содержащих вирусов и фитоплазм. Со времени открытия обратной транскриптазы ОТ-ПЦР стала эталонной технологией для обнаружения и/или сравнения уровней РНК по нескольким причинам: не требует обработки после ПЦР, широкий диапазон (> 107-кратного) содержания РНК может быть измерен, и это дает представление как о качественных, так и количественных данных. Благодаря своей простоте, специфичности и чувствительности ОТ- ПЦР используется в широком спектре приложений - от простых экспериментов, таких как количественное определение клеток микроорганизмов в объекте, до более сложных методов диагностики для обнаружения инфекционных агентов заболеваний растений.
Так, основой диагностики вироида веретеновидности клубней картофеля ВВКК (PSTVd), поражающего и овощные культуры, методом ПЦР является построение на матрице вироидной РНК, комплементарной ДНК, а затем регистрации продуктов амплификации.
Специалистами ВИЗР и Института ядерной физики РАН для ПЦР при диагностике ВВКК были синтезированы три праймера, один со стороны 3» конца (праймер 285), другой — со стороны 5» конца (праймер 2), третий (праймер 260) представлял средний участок цепи. Праймер 285 был использован для синтеза к-ДНК, праймеры 2 и 260 — для амплификации и контроля синтеза минус-цепи, которая была образована с помощью фермента ДНК-полимеразы или обратной транскриптазы [48, 49].
В МГУ для амплификации ВВКК применяются праймеры PSTV- rev (gaaaaaagaaggcggctcggagga), внутренние праймеры BamHl (ggatcc), PSTV-forward (gccgacaggagtatttc) и HpaII (ccgg), имеющие аналогичные последовательности в РНК вироида при участии фермента обратной транскриптазы AMV [46].
Во ВННИФ для идентификации ВВКК применяются праймеры: PSTVd180F (5’-TCACCCTTCCTTTCTTCGGGTGTC-3’) + PSTVd179R (5’-AAACCCTGTTTC- GGCGGGAATTAC-3’) и PSTVd112F (5 ’-ACTGGCAAAAAAGGACGGTGGGGA-3 ’) + PST- Vd359R (5’-AGGAACCAACTGCGGTTCCAAGGG-3’) [106].
ПЦР в модификации FLASH - метод ПЦР с детекцией по «конечной точке» позволяет учитывать результаты ПЦР не открывая пробирки, непосредственно после проведения ПЦР, что исключает возможность загрязнения ПЦР-лаборатории ампликонами. ПЦР в модификации FLASH исключает стадии анализа продуктов ПЦР методом электрофореза и гель-документации результатов электрофореза, что позволяет сократить время полного ПЦР-анализа до 2-3 ч и снизить стоимость комплекта оборудования для ПЦР-лаборатории. Регистрация флуоресценции при FLASH-детекции происходит по окончании реакции ПЦР (по «конечной точке» - «end-point detection») на детекторе флуоресценции, который регистрирует флуоресцентное свечение реакционной смеси в пробирках непосредственно после проведения ПЦР.
В Российской Федерации в настоящее время имеется надежная база для диагностики вирусов и вироида веретеновидности клубней картофеля - PSTVd, которые могут инфицировать и овощные паслёновые культуры. Диагностические наборы производят отечественные фирмы «АгроДиагностика» (в форматах FLASH-ПЦР и realtime ПЦР) и «Синтол» (в формате real-time ПЦР). В научно-методическом отделе фитопатологии ФГБУ «ВНИИКР» проведена отработка комплекса вопросов по выявлению PSTVd методами классической ПЦР, FLASH-ПЦР и ПЦР в режиме реального времени. При отработке диагностики PSTVd методом FLASH-ПЦР установлено, что при проведении тестов с набором для FLASH-ПЦР к PSTVd фирмы «АгроДиагностика» эффективная очистка РНК вироида достигается наборами для выделения нуклеиновых кислот отечественных фирм-производителей: «Проба-НК», «Проба-ГС» («АгроДиагностика») и «НК-М-Со- рб» («Синтол») при проведении очистки вручную, a также набором «М-Сорб-Туб-Автомат» («Синтол») - на автоматической станции для выделения нуклеиновых кислот Freedom Evo (Tecan, Швейцария).
Установлено также, что для FLASH-ПЦР синтез кДНК вироида может осуществляться набором реагентов для обратной транскрипции фирмы «АгроДиагностика», содержащим праймер Random, MMLV RT Kit («Евроген», Россия), содержащим праймеры Oligo (dT)17 и Random dN10 и набором Maxima First Strand cDNA Synthesis Kit (ThermoScientific, США), содержащим праймеры Oligo (dT)18 и Random (dN)6. Набор для FLASH-PCR к PSTVd фирмы «АгроДиагностика» позволяет выявлять все изоляты вироида в свежих и замороженных при температуре -80 °С листьях и клубнях растений картофеля и листьях томата. Ложноположительной реакции с аналогичными органами здоровых растений картофеля и томата не наблюдалось. Чувствительность данного метода является очень высокой.
В экспериментах выявление вироида достигалось при разведении инфекционного сока листьев томата до 106 степени. Аналитическая воспроизводимость и повторяемость результатов при проведении тестов набором для FLASH-PCR к PSTVd составляла 100%. Установлена возможность использования препаратов нуклеиновых кислот, подготовленных для бактериологической экспертизы (шейкирование образцов клубней в буфере, центрифугирование суспензии, выделение нуклеиновых кислот наборами «Проба-ГС» или «М-Сорб-Туб-Авто- мат»), также и для выявления PSTVd. В нескольких экспериментах выявление вироида было достигнуто без выделения нуклеиновых кислот непосредственно в отцентрифугированной суспензии, однако воспроизводимость этих результатов была недостаточно высокой.
Специалистами ВНИИКР проведена валидация диагностического набора к PSTVd для ПЦР в режиме реального времени фирмы «Синтол». В наборе фирмы «Синтол» обратная транскрипции совмещена в одной пробирке с ПЦР, что уменьшает возможность контаминации и сокращает продолжительность тестов. При проведении валидации не наблюдалось неспецифической реакции используемых в наборе праймеров с различными вирусами. Аналитическая чувствительность данного набора находится в пределах шестого разведения инфекционного сока растений томата и седьмого разведения очищенной РНК вироида. Аналитическая воспроизводимость и аналитическая повторяемость результатов при использовании испытуемого набора составили 100%. Установлено, что для проведения тестов с данным комплектом реагентов очистку РНК вироида возможно проводить с различными наборами для выделения нуклеиновых кислот: «Проба-НК», «Проба-ГС» («АгроДиагностика») «НК-М- Сорб», «М-Сорб-Туб-Автомат» («Синтол»), «RNAqueous Kit» (Life Technologies). Набор для real-time-PCR фирмы «Синтол» позволяет выявлять PSTVd в свежих и замороженных при температуре -80°С листьях растений томата и др. Ложноположительной реакции с аналогичными органами здоровых растений не наблюдалось. Набор позволяет также выявлять вироид в образцах сока, нанесенных на мембраны для архивирования нуклеиновых кислот.
По результатам отработки выделения РНК PSTVd констатировано преимущество наборов для выделения нуклеиновых кислот «НКМ-Сорб» фирмы «Синтол» и «Проба-НК» фирмы «АгроДиагностика» по сравнению с набором «RNAqueous Kit» фирмы Life Technologies (США). Это было установлено при последующей ОТ-ПЦР выделенной РНК с наборами для амплификации «MasDRTaqMix-2025» и «Tersus PCR Kit» («Евроген»).
По результатам проведенных экспериментов можно сделать вывод, что праймеры PРSTV-1P/PPSTV-1M могут быть эффективно использованы для диагностики PSTVd. Для проведения ПЦР с данными праймерами возможно применение различных комплектов реагентов для обратной транскрипции и амплификации, a также препаратов РНК, выделенной с использованием различных методов. Валидность продуктов амплификации, полученных в тестах с праймерами PPSTV-1P/PPSTV-1M и 3H1-F/2H1-R, была подтверждена их секвенированием [107].
В МГУ для экстракции вирусной РНК из зараженных растений разработан новый метод, основанный на выделении нуклеиновых кислот с помощью водорастворимого нетоксичного хаотропного трихлорацетата аммония и их очистке на целлюлозном сорбенте на основе хлопковой ваты. Разработан новый метод лабораторной диагностики вирусов растений, основанный на дот-гибридизации вирусной РНК или продукта ее амплификации c кДНК-зондом меченным хлордиэтилентриаминоплатиной [диен(PT)] [94].
ПЦР в реальном времени (Real-Time PCR) - технология получила широкое распространение в исследовательских и диагностических лабораториях. Ее принципиальными особенностями являются мониторинг и количественный анализ накопления продуктов полимеразной цепной реакции, автоматическая регистрация и интерпретация полученных результатов (рис. 26).
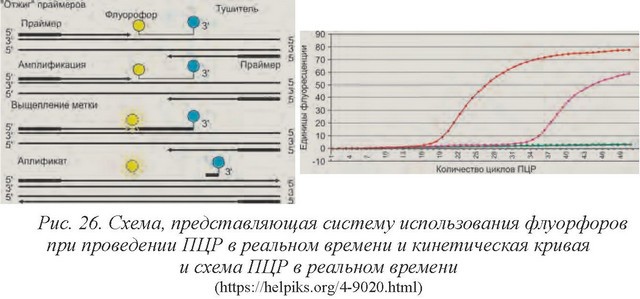
Основные преимущества ПЦР в реальном времени по сравнению с методом анализа по конечной точке:
• количественный анализ специфической ДНК в широком диапазоне концентраций;
• сравнительный количественный анализ нескольких типов ДНК в одной пробирке;
• повышение специфичности реакции за счет использования ги- бридизационных зондов;
• обнаружение и определение процентного содержания ДНК с измененной последовательностью;
• исключение после амплификационных манипуляций с продуктом и, как следствие, снижение риска контаминации (загрязнения), экономия времени и сокращение затрат на поддержание ПЦР-лаборатории;
• автоматизация и стандартизация ПЦР-анализа.
Для ПЦР в реальном времени российская научно-производственная компания «Синтол» реализуют наборы реагентов «Фитоскрин» для обнаружения патогенов, способных заражать овощные культуры:
• «Acidovorax citrulli-РВ» - для выявления ДНК возбудителя бактериальной пятнистости тыквенных культур (№ PH-006);
• «Beet necrotic yellow vein virus-РВ» - для выявления РНК вируса некротического пожелтения жилок сахарной свеклы (ризомания сахарной свеклы) методом ОТ-ПЦР-РВ (№ PH-010);
• «Tomato yellow leaf curl disease-РВ» - для выявления ДНК бегомовирусов, возбудителей болезни желтой курчавости листьев томата (№ PH-018 new);
• «Tomato ringspot virus-РВ» - для выявления РНК вируса кольцевой пятнистости томата методом ОТ-ПЦР-РВ (№ PH-028);
• «Clavibacter michiganensis subsp. michiganensis-РВ» - для выявления ДНК возбудителя бактериального рака томата (№ PH-041new);
• «Tomato spotted wilt virus-РВ» - для выявления РНК вируса бронзовости томата методом ОТПЦР-РВ (№PH-042new);
• «Tobacco ringspot virus-РВ» - для выявления РНК вируса кольцевой пятнистости табака методом ОТ-ПЦР-РВ(№PH-040New);
• «Impatiens necrotic spot virus-РВ» - для выявления РНК вируса некротической пятнистости бальзамина методом ОТ-ПЦР-РВ (№ PH-013);
• «Potato Virus X и Potato Virus Y-РВ» - для дифференциальной диагностики и выявления РНК вирусов картофеля методом ОТ-ПЦР-РВ (№ PV-001);
• «Potato Virus M и Potato Leafroll Virus-РВ» - для дифференциальной диагностики и выявления РНК вирусов картофеля методом ОТ-ПЦР-РВ (№ PV-002);
• «Potato Virus S и Potato Virus A-РВ» - для дифференциальной диагностики и выявления РНК вирусов картофеля методом ОТ-ПЦР-РВ (№PV-003);
• «Potato spindle tuber viroid-РВ» - для выявления РНК вироида ве- ретеновидности клубней картофеля методом ОТ-ПЦР-РВ (№ PV-004);
• «Potato Virus X, Y, M, L, S, A, PSTVd-РВ» - для выявления РНК вирусов (PVX, PVY, PVM, PLRV, PVA, PVS и PSTVd) картофеля (состоит из комплекта наборов PV-001, PV-002, PV-003, PV-004) (№ PV-005);
• «Candidatus Phytoplasma solani-РВ» - для выявления ДНК фитоплазмы почернения древесины или столбура паслёновых (№ PH-02);
• «Candidatus Liberibacter solanacearus-РВ» - для выявления ДНК возбудителя заболевания картофеля «Зебра чипсов» (№ PH-019).
Наборы реагентов «Фитоскрин» для выявления фитопатогенов методом ПЦР в реальном времени разработаны совместно с Всероссийским центром карантина растений и утверждены Федеральной службой по ветеринарному и фитосанитарному надзору в 2013 г. Перечень наборов «Фитоскрин» постоянно пополняется новыми наборами на актуальные инфекции растений [108].
В ФГБУ «Всероссийский центр карантина растений» проведены исследования по выбору наиболее специфичных к объектам исследования праймеров и зондов для проведения ПЦР в режиме реального времени. Так, для достоверного (без ложноположительных реакций) выявления возбудителя почернения коры винограда BN или столбура паслёновых предлагаются пары праймеров и BNrtF/ BNrtR и зонд BN-FAM (BNrtF: GGT TAA GTC CCG CAA CGAG; BNrtR: CCC ACC TTC CTC CAA TTT ATCA; BN-FAM AAC CCT TGT TAA TTG CCA TCA TTA AG). Реакционная смесь включает в себя 5 мкл мастермикса, по 0,75 мкл каждого праймера и зонда, 2,5 мкл ДНК и 15,25 мкл H2O для доведения до общего объема в 25 мкл. Температурно-временные условия следующие: предварительная денатурация - 95 °С, денатурация 95 °С - 15 мин, элонгация 59 °С - 1 мин 30 с. Амплификации составляли 45 циклов. Дополнительно в режим был включен прогрев при температуре 50 °С на 2 мин, что заявлено в инструкции амплификатора для ПЦР-РВ StepOnePlus («Appliedbiosystems», США) [96, 97].
Матричный микрочиповый метод ПЦР в реальном времени. В ООО «Генбит» при участии учёных ВНИИФ разработаны тест-системы для ПЦР в реальном времени, работающие в едином режиме амплификации, для идентификации гриба - Phytophthora infestans, бактерий - Pectobacterium atrosepticum, Dickeya dianthicola, Dickeya solani, Ralstonia solanacearum, Pectobacterium carotovorum, Clavi- bacter michiganensis subsp. sepedonicus, Y-вирусы картофеля (обычные и некротические формы, а также система неизбирательного тестирования, обнаруживающая все формы), A-, X-, S-, M-, L-, MopTop-вирусов картофеля и вироида - ВВКК. Тест-системы (включая полимеразу и ревертазу) были иммобилизованы и лиофилизированы в миниатюрные микрореакторы (1-2 мкл) на кремниевых микрочипах ДНК/РНК (микроматрицы) для использования с мобильным усилителем AriaDNA. Предварительно загруженные микроматрицы с 30 реакциями, сроком хранения 3 и 6 месяцев (для возбудителей на основе РНК и ДНК) без особых условий хранения (при комнатной температуре) были успешно протестированы на эталонных и полевых образцах и продемонстрировали высокую чувствительность (1пг) по сравнению с традиционным ИФА и микробиологическими методами.
Миниатюризация и создание микрожидкостных или стационарных микрочиповых систем стало следующим шагом в развитии методов ПЦР, которые позволяют проводить ПЦР в микрореакторах объемом всего несколько десятков пиколитров [16, 17]. Помимо удешевления реагентов такой миниатюрный реакционный объем обеспечивает более быстрый и точный контроль температуры, что сокращает общее время анализа и повышает эффективность реакции. Обеспечить широкое применение микрочиповой ПЦР-системы для диагностических целей способны простота в использовании и низкая себестоимость микрочипов. Как правило, микрофлюидные микрочипы не соответствуют этим требованиям, а стационарные микрочипы с открытыми микрореакторами вполне подходят в качестве основы для создания диагностических систем (Сляднев, 2012).
Попытка разработать оптимизированные диагностические системы на основе стационарных микрочипов также была предпринята в России AriaDNA (Наволоцкий и др., 2010; Наволоцкий и др., 2011). Эта система основана на использовании одноразового микрочипа из кремния или алюминиевого сплава. Микрочип состоит из 48 микрореакторов/лунок и обеспечивает одновременную мультиплексную ПЦР в режиме реального времени. Высокая теплопроводность микрочипа сокращает время усиления до 20-30 мин. Специальная модификация поверхности стружки обеспечивает гидрофильную зону внутри лунки и гидрофобную зону за ними, что гарантирует надежное удерживание образцов в лунках во время термоциклирования и предотвращает перекрестное загрязнение и ингибирование реакции. Флуоресцентный сигнал регистрируется для каждой лунки индивидуально, поэтому вмешательство сигналов от соседних лунок устраняется. Еще одно важное преимущество системы: все компоненты реакционной смеси (включая полимеразу и обратную транскриптазу) можно лиофилизировать в лунках, что сокращает время, необходимое для анализа, и упрощает процедуру, - оператор должен только подготовить ДНК или образцы РНК и добавить их в лунки под слой уплотнительного минерального масла [109].
Эксперименты показали отличную воспроизводимость и высокую эффективность систем: все искомые нуклеиновые кислоты были обнаружены и идентифицированы в образцах, содержащих ДНК/РНК одного патогена, а также в образцах, содержащих смесь ДНК/РНК несколько патогенов. Расход реагентов для ПЦР в 20 раз меньше по сравнению с классической пробиркой формата анализа ПЦР, а время амплификации составляет всего 33 мин на 45 циклов, что как минимум в 2 раза быстрее, чем классический ПЦР. К недостаткам систем следует отнести отсутствие единого метода, который бы обеспечивал оптимальное извлечение ДНК/РНК из любого типа образца, поэтому отбор проб и выбор метода экстракции может привести к ложным результатам (в основном отрицательным). Интерпретация результатов может быть сложной, особенно в случае вирусных патогенов [97].
В полевых условиях часто отмечается заражение растения комплексом патогенов. Всё это усложняет установление этиологии возбудителей. Для преодоления этих трудностей разработана мультиплексная ПЦР.
Мультиплексная ПЦР, мультипраймерная ПЦР, в которой одновременно используют более одной пары олигонуклеотидных праймеров, что приводит к коамплификации нескольких ДНК-матриц. Такая реакция позволяет экономить время, она широко используется для экспресс-идентификации инфекционных агентов, скрининга сразу по нескольким инфекционным возбудителям или для исследования состояния нескольких аллельных генов у эукариотических организмов. Мультиплексная ПЦР - перспективная методика, которая требует более строгой оптимизации условий, чем стандартная ПЦР с одним ампликоном. При мультиплексной ПЦР необходим правильный подбор параметров реакции (концентрации реагентов и особенностей прохождения каждой стадии), позволяющий всем праймерам соединяться с комплементарными им матрицами и синхронно наращивать ампликоны. Подбор правильных праймеров, ферментов и буфера также является важным фактором, определяющим эффективность мультиплексной ПЦР.
Практика лабораторных исследований показала, что мультиплексная ПЦР имеет ряд преимуществ перед стандартной ПЦР: снижение риска контаминации образца, возможность контроля ложноотрицательных результатов, уменьшение расхода реактивов, сокращение времени подготовки и более высокое качество эталона, количество которого можно определить в образце. В области диагностики инфекционных заболеваний технология показала свою ценность в идентификации бактерий, вирусов, паразитов и грибов [110].
Петлевая изотермическая амплификация - Loop-mediated isothermal amplification (LAMP) - метод изотермической амплификации нуклеиновых кислот. В отличие от технологии ПЦР, в которой реакция проводится с серией чередующихся температурных стадий или циклов, изотермическая амплификация проводится при постоянной температуре и не требует термоциклера.
В LAMP последовательность-мишень амплифицируется при постоянной температуре 60-65 °C с использованием двух или трех наборов праймеров и полимеразы с высокой активностью замещения цепи в дополнение к активности репликации. Обычно для амплификации шести отдельных областей гена-мишени используют четыре разных праймера, что увеличивает специфичность. Дополнительная пара «петлевых праймеров» может еще больше ускорить реакцию. Количество ДНК, продуцируемой в LAMP, значительно выше, чем при амплификации на основе ПЦР.
Продукт амплификации может быть обнаружен с помощью фотометрии, измерения мутности, вызванной осадком пирофосфата магния в растворе как побочным продуктом амплификации. Это позволяет легко визуализировать невооруженным глазом или с помощью простых фотометрических подходов к обнаружению небольших объемов. За реакцией можно следить в реальном времени путем измерения мутности или флуоресценции с использованием интеркалирующих красителей, таких как SYTO 9 [111-113].
Красители, такие как зеленый SYBR, можно использовать для создания видимого изменения цвета, которое можно увидеть невооруженным глазом без необходимости в дорогостоящем оборудовании, или для реакции, которую можно более точно измерить с помощью приборов. Молекулы красителя интеркалируют или непосредственно метят ДНК и, в свою очередь, могут коррелировать с количеством изначально присутствующих копий. Следовательно, LAMP также может быть количественным. Определение в пробирке амплификации ДНК LAMP возможно с использованием нагруженного марганцем кальцеина, который начинает флуоресцировать при комплексообразовании марганца с пирофосфатом во время синтеза ДНК in vitro [114].
Другой метод визуального обнаружения LAMP-ампликонов невооруженным глазом основан на их способности гибридизоваться с комплементарной ss-ДНК, связанной с золотом, и таким образом предотвращать нормальное изменение цвета с красного на пурпурно-синий, которое в противном случае произошло бы во время индуцированной солью агрегации золотых частиц. Таким образом, метод LAMP в сочетании с обнаружением ампликона с помощью AuNP может иметь преимущества по сравнению с другими методами с точки зрения сокращения времени анализа, подтверждения ампликона гибридизацией и использования более простого оборудования (например, отсутствие необходимости в термоциклере, оборудовании для электрофореза или ультрафиолетовом трансиллюминаторе) [115].
LAMP - относительно новый метод амплификации ДНК, который благодаря своей простоте, прочности и низкой стоимости может обеспечить значительные преимущества [116, 117]. Было обнаружено, что LAMP менее чувствителен (более устойчив), чем ПЦР, к ингибиторам в сложных образцах, вероятно, из-за использования другой ДНК-полимеразы (обычно Bst - Bacillus stearothermophilus - ДНК-полимеразы, а не Taq-полимеразы, как в ПЦР). В нескольких отчетах описывается успешное обнаружение патогенов в минимально обработанных образцах, таких как термически обработанная кровь или в присутствии матриц клинических образцов [118, 119]. Эта функция LAMP может быть полезна в условиях ограниченных ресурсов или в полевых условиях, где обычная экстракция ДНК или РНК до диагностического тестирования может быть непрактичной.
LAMP менее универсален, чем ПЦР. Поскольку LAMP использует четыре (или шесть) праймеров, нацеленных на шесть (или восемь) областей в пределах довольно небольшого сегмента генома, и поскольку дизайн праймеров подвержен многочисленным ограничениям, сложно разработать наборы праймеров для LAMP «на глаз». Бесплатные пакеты программного обеспечения с открытым исходным кодом [120] или коммерческие обычно используются для помощи в разработке праймеров LAMP, хотя ограничения дизайна праймеров означают, что свобода выбора целевого сайта меньше, чем при ПЦР.
В диагностическом приложении это должно быть сбалансировано с необходимостью выбора подходящей мишени (например, консервативного сайта в очень вариабельном вирусном геноме или мишени, специфичной для определенного штамма патогена). Для покрытия различных вариантных штаммов одного и того же вида может потребоваться несколько вырожденных последовательностей. Следствием наличия такого набора праймеров может быть неспецифическая амплификация на поздней стадии амплификации.
Подходы к мультиплексированию для LAMP менее развиты, чем для ПЦР. Большее количество праймеров на мишень в LAMP увеличивает вероятность взаимодействий праймер-праймер для мультиплексированных наборов мишеней. Продукт LAMP представляет собой серию конкатемеров целевой области, приводящую к характерной «лестнице» или полосе на геле, а не к одной полосе, как в случае ПЦР. Хотя это не проблема при обнаружении одиночных мишеней с помощью LAMP, «традиционные» (конечные) приложения мультиплексной ПЦР: в которых идентичность цели подтверждается размером полосы на геле, невозможны с LAMP. Мультиплексирование в LAMP было достигнуто за счет выбора целевой области с сайтом рестрикции и переваривания перед запуском в гель, так что каждый продукт дает определенный размер фрагмента [121], хотя этот подход добавляет сложности к экспериментальной конструкции и протоколу.
Использование ДНК-полимеразы с замещением цепи в LAMP также исключает использование зондов гидролиза (зонды TaqMan, основанные на 5’-3’-экзонуклеазной активности Taq-полимеразы). Сообщалось об альтернативном подходе к мультиплексированию в реальном времени, основанном на тушителях флуоресценции [122]. Зеленый краситель SYBR может быть добавлен для просмотра LAMP в режиме реального времени. Однако в поздней амплификации амплификация праймер-димер может способствовать ложноположительному сигналу. В отличие от традиционных ПЦР-тестов на основе SYBR-green, анализ кривой плавления не может быть проведен в LAMP для проверки наличия димеров праймеров.
Источник: Методы диагностики возбудителей заболеваний овощных культур: аналит. обзор. –М.: ФГБНУ «Росинформагротех», 2020. – страница 71-89



















