Методов серодиагностики основаны на иммуногенных и антигенных свойствах возбудителей, имеющих белок, и позволяют установить вид патогена, определить концентрацию и локализацию возбудителя в клетках и тканях растений. Серодиагностика широко применяется в фитопатологии для диагностики вирусных, фитоплазменных, бактериальных и грибных заболеваний.
Получение антисывороток. Диагностические сыворотки можно получить, вводя очищенный препарат вируса в организм различных видов животных. Очищаются фитопрепараты методами дифференциального центрифугирования. В зависимости от вида патогена варьируют и схемы введения антигена животным. После завершения цикла инъекций у животного берут кровь для получения из нее сыворотки, которую после соответствующей обработки разливается по ампулам и подвергается лиофильной сушке [43, 66, 68, 78].
Капельный метод. Получил широкое практическое применение в ХХ в. В ходе исследования на стекло наносят каплю диагностической сыворотки и каплю нормальной (контрольной) антисыворотки (из крови животного, не подвергавшегося введению антигена). К каждой из них добавляют по капле сока из анализируемого растения, после чего капли смешивают и выдерживают во влажной камере при температуре 22 °С в течение 40 мин. Нормальная сыворотка служит контролем. Реакция считается положительной, если в капле с антисывороткой виден четкий осадок, отсутствующий в капле с нормальной сывороткой (рис. 21 а). Для чтения реакции используется бинокулярная лупа с увеличением в 20-25 раз [43, 66, 68, 78].
Энзимосвязанный иммуносорбентный тест (ELISA-тест, ИФА) - высокочувствительный серологический метод, в основе которого лежит использование связанных с энзимами антител для определения специфических антигенов (белков возбудителей). Основные области использования ELISA в фитопатологии - детекция и количественное определение патогенов в растениях, почве или других образцах, выявление инфицированных растений до появления симптомов заболевания, а также отбор здоровых семян или посевного материала. Относительно простой и недорогой иммуноанализ быстро сделал эти методы популярными. Количество тестов ELISA, используемых для обнаружения сельскохозяйственных патогенов во всем мире, достигает 10 млн в год [80, 81].
В качестве энзимов используют щелочную фосфатазу с ее субстратом п-нитрофенил фосфатом или пероксидазу. Принцип метода состоит в следующем:
• антитела, специфичные для определенного вида возбудителя, адсорбируются на специальных пластиковых пластинах с углублениями-колодцами (0,5 мм). С этой целью в колодцы добавляют раствор y-глобулиновой фракции антисыворотки;
• после инкубирования неадсорбированные антитела отмывают и затем добавляют сок больного растения. Если вирус присутствует в соке, он будет реагировать с адсорбированными антителами и, таким образом, связываться с пластинкой;
• затем в колодцы добавляют раствор, содержащий антитела, связанные с энзимом. Если вирус находится в колодце, то он связывается с энзимом. При промывании удаляется несвязанный конъюгат и в колодец добавляют энзимный субстрат.
После инкубационного периода измеряют активность энзима. Количество гидролизата прямо пропорционально количеству возбудителя. Интенсивность окраски также пропорциональна концентрации вируса (рис. 21б).
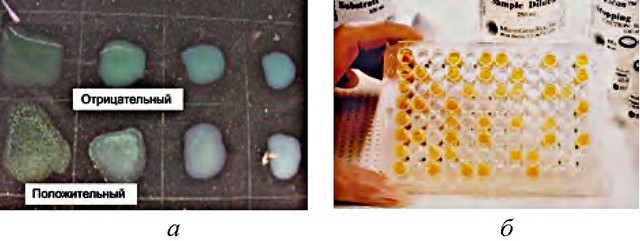
Рис. 21. Капельный метод (а) - первая капля во втором ряду с образованием хлопьевидного осадка свидетельствует о наличии в образце вируса, специфичного к данной антисыворотке
(http://science-fund.kz/o-fonde/nashi-proekty/2017/razrabotka-i-organizaciya-proizvodstva-roz-bengal-antigena-dlya-plastinchatoj-reakcii-agglyutinacii-pri-diagnostike-bmcelleza-zhivotnyh)
микропланшет ИФА (ELISA) (б) - цветные лунки указывают на реактивность, чем интенсивнее цвет, тем выше реакционная способность и концентрация вируса
(https://virology-online.com/general/Tests.htm)
Твердофазный иммуноферментный анализ ELISA получил заслуженное признание в диагностической фитопатологии. Разновидности ИФА могут быть отнесены к гомогенным или гетерогенным, в зависимости от того, где происходит специфическое взаимодействие «антиген-антитело». При гомогенном анализе все стадии, включая ферментативную реакцию, происходят в растворе. Гетерогенный вариант анализа предполагает разделение свободного и иммунохимически связанного иммунореагента (антигена, антитела) на твердой фазе с помощью иммобилизованных на ней комплементарных реагентов, соответственно, антитела и антигена.
Среди вариантов ELISA различают конкурентные и неконкурентные. Отличительными чертами конкурентного варианта является одновременное присутствие на первой стадии анализа антигена из анализируемого образца и меченого антигена, а также их конкуренция за соединение с ограниченным числом сайтов связывания на антителах. Конкурентный ELISA применяется для диагностики фитопатогенов, но не является широко распространенным, поскольку в качестве иммуногенов в фитопатологии часто используют не индивидуальные антигены, в которые можно ввести метку, а их смеси или просто экстракты.
ELISA называют прямым или непрямым в зависимости от типа антитела, маркированного ферментом. В прямом варианте метода определяемый антиген обнаруживают конъюгатом гомологичных (полученных к данному антигену и специфичных к нему) антител. В непрямом ELISA для связывания целевого антигена используют немеченые гомологичные антитела (ABs1), а затем образовавшийся комплекс «антиген-антитело» детектируют с помощью ферментных конъюгатов других (вторичных, или антивидовых) антител, которые получены против ABs1.
Различают варианты ELISA в зависимости от типа фермента и субстрата (колориметрический, флуориметрический, биолюминес- центный ELISA) или от способа измерения ферментативной активности [82].
На фоне питиозного поражения корней и плодов в защищённом грунте часто развивается фузариоз. Диагностика комплексного заболевания сложна. Обычно доминирует один из возбудителей, его выявляют и назначают средства защиты, другие часто остаются незамеченными. Кроме того, в последние годы на огурце прогрессирует новая болезнь увядания - акремониоз (возбудитель Acremonium striclum). Средства химической борьбы с комплексными заболеваниями не эффективны. Время для защиты от другого патогена часто бывает упущено и растения погибают, а инфекция переносится на соседние.
Для срочной идентификации патогенного комплекса сотрудниками ЦКП «Орловский региональный центр сельскохозяйственной биотехнологии» разработана и апробирована на практике модель биомониторинга ранней зараженности грибными заболеваниями различных видов овощных культур в условиях защищенного грунта с помощью ИФА-анализа системы культур. Также для оздоровления зараженного посадочного материала овощных культур специалистами центра предложено использовать иммунодиагностику, включающую в себя выбраковку больного материала, с помощью полученных в центре антител к конкретно доминирующему возбудителю грибных заболеваний фитопатогену Fusarium oxysporum в условиях защищенного грунта на территории Орловской области [83-89].
Методика проведения предложенного иммуноферментного анализа
Для проведения анализа использовали стерильные планшеты Те- рассаки на 96 лунок с адгезивным покрытием и U-образным дном. Готовили антитела 200 мг/л, нагружали по 100 мкл каждую лунку планшета, инкубировали 2 ч при температуре 4 °С, в атмосфере с 5 % СО2. Троекратно отмывали 300 мкл раствора NaCl (0,15 М) и 7 раз дистиллированной водой.
Вносили по 100 мкл раствора бычьего сывороточного альбумина (10 г/л) в 0,01М фосфатном буферном растворе, содержащем NaCl (0,15М) и ТВИН 20 (0,05% w/v), рН 7,3±0,1, инкубировали 1 ч при комнатной температуре. Промывали по той же схеме.
Подготовленные аликвоты доводили до комнатной температуры. В лунки планшета вносили 25 мкл контрольных и опытных образцов, инкубировали 1 ч при температуре 37 °С на термостатируемом шейкере с частотой встряхивания 650 раз/мин, троекратно отмывали 300 мкл фосфатно-солевого буфера (ФСБ-Т, «Вектор Бест»).
Вносили 100 мкл раствора конъюгата, меченного пероксидазой хрена, инкубировали 30 мин при температуре 37 °С на термостатируемом шейкере с частотой встряхивания 650 раз/мин. Несвязавшийся конъюгат декантировали, лунки планшета отмывали фосфатно-солевым буфером троекратно по 300 мкл.
Вносили 100 мкл хромогена в субстратно-буферном растворе (ТМБ+СБР, «Вектор Бест»), инкубировали 15 мин при комнатной температуре в темном месте. Добавляли 100 мкл HCL 1N (Стоп-реагент, «Вектор Бест») для остановки реакции. Измеряли оптическую плотность при длине волны 450-620 нм против холостой пробы на планшетном фотометре Multiscan EX [3, 6].
Расчет критической и оптической плотности (Cut off) проводили по уравнению
Cut off = А*К- + В*К- + С*КК + D.
При наличии в растительном материале антигенов исследуемого фитопатогена реакционная смесь становится окрашенной, тогда как образцы здоровых растений остаются прозрачными. Изменение окраски и её интенсивность прямо пропорциональна количеству антигена в растительном материале (рис. 22).

Усиленное образование активных форм кислорода АФК является одной из ранних реакций растения на повреждающее воздействие. Специфическим ферментом, препятствующим повреждающему влиянию супероксиданион-радикала кислорода на биологические структуры, является супероксиддисмутаза (СОД, КФ 1.15.1.1) [8389].
Основываясь на том, что супероксиддисмутаза играет важнейшую роль одного из главных представителей антиоксидантной системы защиты живых организмов, сотрудниками ЦКП «Орловский региональный центр сельскохозяйственной биотехнологии» была разработана тест-система биомониторинга ранней зараженности грибными заболеваниями различных сортов овощных культур в условиях защищенного грунта на различных этапах вегетации с помощью иммуноферментного методов анализа и биохимического тестирования (активности фермента супероксиддисмутазы).
Активация СОД при неблагоприятных воздействиях является ответом на увеличение продукции радикалов супероксида в этих условиях, что обеспечивает защиту клеток и тканей растений от окислительных повреждений. Активность СОД при этом изменяется разнонаправлено: в одних случаях возможно ее увеличение, в других - снижение, в зависимости от напряженности действия стрессовых факторов, этапов вегетации растения и др. [90].
Поскольку гидроксильные радикалы, синглетный кислород активно окисляют белковые молекулы, специфических ферментов-дезактиваторов данных АФК не существует, уровень их в клетке опосредованно регулируется СОД путем инактивации супероксидных радикалов - источника их образования. По этой причине СОД является первичной линией защиты от окислительных повреждений, обрывая окисление клеточных макромолекул еще на стадии инициирования [91].
Определение активности супероксиддисмутазы. Для определения активности супероксиддисмутазы была использована модифицированная методика [83, 92].
Растительный материал измельчали с 25 мл фосфатного буферного раствора pH 7,8 и центрифугировали с частотой 7000 мин-1 в течение 15 мин, затем отделяли надосадочную жидкость. Анализ проводили методом фиксированного времени. Реакционная среда объемом 2,5 мл содержала 50 мМ фосфатного буфера с pH 7,8, 13 мМ L-метионина, 75 мкМ нитросинего тетразолия, 2 мкМ рибофлавина, 0,1 мМ ЭДТА и 0,5 мл экстракта СОД. Рибофлавин добавляли в последнюю очередь и размещали контрольные и опытные пробирки в фотореакторе. Через 15 мин реакцию прекращали, выключая лампу фотореактора, затем измеряли оптическую плотность растворов на спектрофотометре Spekol 11 при длине волны 560 нм. Необлученная реакционная смесь не окрашивалась и служила базовой линией для спектрофотометра. Активность СОД рассчитывалась по формуле и выражена в единицах оптической плотности на 1 г сырой массы:
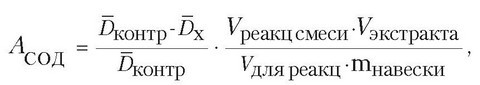
где АСОД - активность супероксиддисмутазы;
Dконтр. - среднее арифметическое из оптических плотностей контрольных растворов;
Dx - среднее арифметическое из оптических плотностей растворов с содержанием экстракта;
Vреакц. смеси - общий объем реакционной смеси;
Vэкстракта - общий объем экстракта;
Vдля реакции - объем экстракта, взятого для реакции;
mнавески - масса навески биологического материала.
Экспресс-метод ИФА (иммунострипы)
Для быстрого выявления различных болезней растений созданы тест-системы, с помощью которых в полевых условиях можно подтвердить наличие инфекции. Подобное оборудование уже с 1981 г. выпускает американская фирма Flashkits Agdia Inc. (США). Алгоритм диагностики включает в себя выделение сока из части листа (0,15 г) исследуемого растения в емкость; погружение иммунострипа на 0,5 см до метки «sample» в сок; ожидание результата в течние 5-30 мин [84, 92]. По мере выполнения теста появляются одна или две полоски, указывающие соответственно на отрицательный или положительный результат (рис. 23).
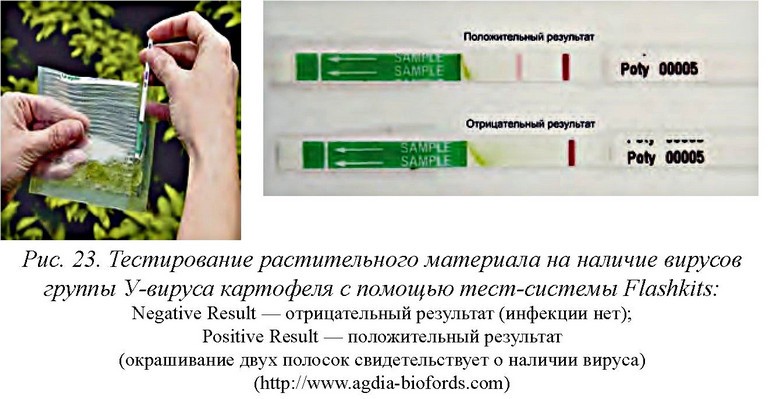
Для диагностики патогенов на овощных культурах Agdia предлагает самый большой ассортимент коммерческих тест-систем на определение более 40 наиболее вредоносных фитовирусов и вироида веретеновидности клубней картофеля, их штаммов и групп [93].
Для экспрессного определения фитовирусов во внелабораторных условиях в МГУ разработан новый метод виробактериальной агглютинации (АБВ-тест), основанный на коагглютинации вирусных частиц и протеина А из клеток стафилококка Staphylococcus aureus, покрытых антителами к вирусу. Совместно с Институтом биохимии имени А.Н. Баха РАН впервые в России разработана технология получения мультимембранных композитов (тест-полосок) для внелабораторной диагностики вирусов растений методом иммунохроматографии, основанным на использовании поликлональных антител к вирусам и частиц коллоидного золота в качестве маркера.
Отечественные иммунохроматографические тест-системы для визуальной экспресс-диагностики вирусных инфекций картофеля на поликомпозитных мембранных тест-полосках разрабатывали кафедры вирусологии биологического факультета МГУ, ИФХБ имени АН. Белозерского, ЗАО НВО «Иммунотех» и ВНИИКХ. В результате были созданы отечественные иммунохроматографические тест-системы и отработаны методические аспекты экспресс диагностики Х-, М- и Y-вирусов картофеля [94, 95], многие из них подходят и для определения патогенов, поражающих овощные культуры.
Метод ИХА в его современном и наиболее распространенном формате применительно к диагностике патогенов растений выглядит следующим образом. Тест-полоска представляет собой мульти- мембранный композит, состоящий из впитывающей мембраны, погружаемый в образец. Мембраны для нанесения конъюгата антител выполнены с частицами коллоидного золота; на рабочей мембране в аналитической зоне фиксированы антитела к определяемому вирусу, а в контрольной зоне - антитела к IgG кролика (или мыши); другая (впитывающая мембрана) поддерживает поток жидкости по полоске.
Все мембраны монтируются на пластиковой подложке, обеспечивающей единство конструкции и механическую прочность тест-полоски, и покрыты сверху прозрачной пленкой или заключены в пластиковую кассету. При погружении тест-полоски в экстракт патогена, продвигаясь по полоске с фронтом жидкости, связывается с конъюгатом, а затем с антителами, фиксированными в аналитической зоне. Концентрирование связанных с патогеном частиц коллоидного золота приводит к образованию в этом месте окрашенной полосы. Избыток конъюгата улавливается антивидовыми антителами, в результате чего в контрольной зоне тоже образуется окрашенная полоса. При отсутствии патогена в экстракте (здоровое растение) окрашенная полоса в аналитической зоне не образуется. Если окрашенная полоса не образуется в контрольной зоне, тест признается недостоверным независимо от того, образовалась ли полоса в аналитической зоне.
Высокая скорость анализа, занимающего всего несколько минут, высокая чувствительность определения вирусов, простота подготовки образцов и процедуры анализа позволяют использовать метод во внелабораторных и полевых условиях. Чувствительность определения варьирует в интервале от 0,08 до 2 мкг/мл в экстрагирующем буфере и в растительном экстракте и зависит главным образом от свойств поликлональных антител к соответствующему патогену. Метод отличается высокой специфичностью. Это обстоятельство позволило создать лабораторный образец тест-полосок для одновременного определения трех вирусов ХВК, YBK и ВТМ путем формирования трех аналитических зон на одной полоске. Поскольку время анализа при этом не увеличилось, применение мультиспецифичных тест-полосок способствует повышению производительности процедуры диагностики [94].
В ФГБНУ ВНИИКХ имени А.Г. Лорха реализуются иммуно-ферментные диагностические наборы для выявления, идентификации и количественного определения и иммунохроматографические диагностические комплекты для экспресс-диагностики (PVX, PVS, PVM, PVY, PLRV). ООО «Компания «Биоком» совместно с ГНУ ВНИИ картофельного хозяйства имени А.Г. Лорха, МГУ имени М.В. Ломоносова и ЗАО «НВО ИММУНОТЕХ» организовала выпуск диагностических наборов для определения вирусных патогенов (Иммунотест-ХВК, Иммунотест-УВК, Иммунотест-МВК, Иммунотест-АВК, Иммунотест-SВК, Иммунотест-ВСЛК). Использование высокоочищенных препаратов высокоспецифичных высо- коаффиных иммобилизованных и меченых антител производства ВНИИ картофельного хозяйства имени А.Г. Лорха (Россия) и фирмы «Bioreba» (Швейцария) обеспечивает высокую специфичность анализа. Минимальная концентрация вируса, определяемая с помощью набора, составляет не более 1 нг/мл, а бактериальных патогенов — не более 104 кл/мл. Коэффициент вариации результатов определения вирусного антигена в одном и том же тестируемом образце не превышает 10 %. Тест-система может быть использована в диапазоне концентраций определяемого антигена от 1 до 1000 нг/мл для вирусов и 104-108 кл/мл - для бактериальных патогенов [96].
В научных исследованиях также используются различные модификации серологического метода, электронной и электронно-сканирующей микроскопии, позволяющие определить форму, размеры фитопатогенов и их вариации, приуроченность к органам и тканям растения или переносчика, характер патологии.
Источник: Методы диагностики возбудителей заболеваний овощных культур: аналит. обзор. –М.: ФГБНУ «Росинформагротех», 2020. – страница 61-71



















